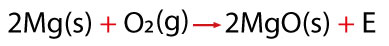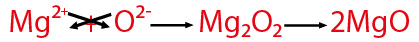Un ejemplo de las reacciones del oxígeno con un metal, es la que ocurre con el magnesio al someterlo a la reacción de oxidación en una flama, pues desprende una intensa luz blanca y se convierte en un sólido blanco muy frágil; el producto de esta reacción es un óxido metálico llamado óxido de magnesio.
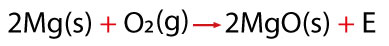
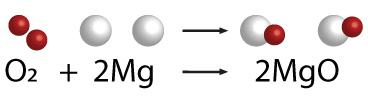
A nivel molecular lo que ocurre en el video es lo siguiente:
El producto final tiene un coeficiente 2 precediendo a la fórmula MgO, ésta es la fórmula mínima del óxido del magnesio, pero ¿a qué se debe?
Si se considera que la fórmula se escribe como el resultado del entrecruzamiento de valencias, en el ejemplo (2+) para el magnesio (Mg) y (2-) para el oxígeno (O), se representa la fórmula como Mg2O2 entonces ¿por qué se escribe simplemente como MgO?
Porque al escribir las fórmulas, se considera la expresión mínima a través de su mínimo común divisor, en este caso al dividir 2/2=1,
La fórmula de un compuesto tiene que ser eléctricamente neutra, esta condición se cumple para el óxido de magnesio MgO (2+)(2-)= 0 .
Como observas en el ejemplo del modelo molecular, en esta reacción se obtienen dos moléculas de óxido de magnesio.
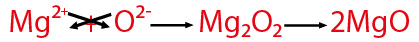
Todo cambio químico puede ser descrito a través de una ecuación que nos muestra las transformaciones que ocurren cuando interactúan dos o más sustancias entre sí. De esta forma podemos describir las variaciones que se realizan cuando se oxidan los elementos no metálicos en presencia de oxígeno y con el auxilio de la energía calorífica. Se puede tomar como ejemplo el carbono, cuando éste es sometido a la reacción de oxidación en la flama, se lleva a cabo su combustión y se desprende un gas llamado monóxido de carbono, en el caso de su valencia de menor valor; en la otra posibilidad cuando la valencia de intercambio del carbono es la mayor, forma el dióxido de carbono. En ambas reacciones hay desprendimiento de energía, el producto de estas reacciones son óxidos no metálicos.
A nivel molecular lo que ocurre en el video es lo siguiente:
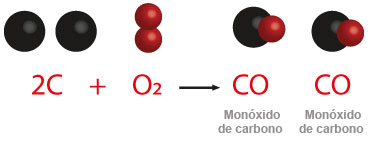
Observarás que se forman dos moléculas de monóxido de carbono. La otra posibilidad es cuando el carbono actúa con la valencia de 4+, como se muestra enseguida:
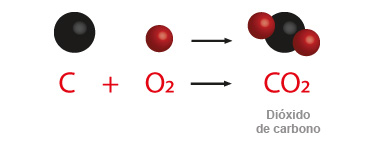
Efectivamente, aquí sólo se forma una molécula de dióxido de carbono.