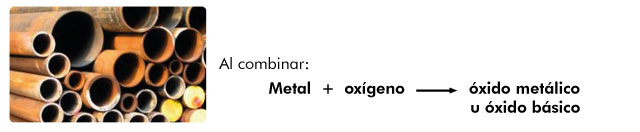
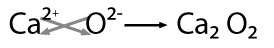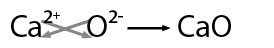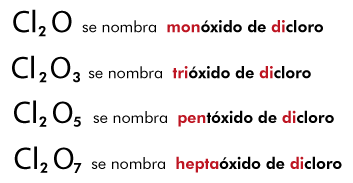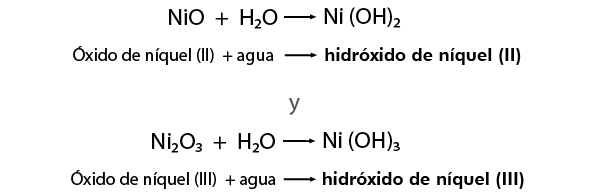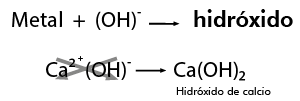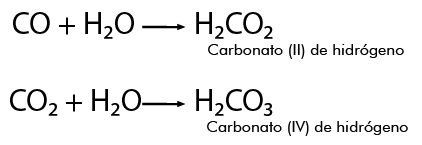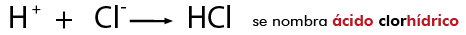Resultan de la combinación del oxígeno con metales y al reaccionar con el agua producen bases.
Nomenclatura Stock
Se nombra con la palabra genérica óxido seguido de la preposición de enseguida el nombre del metal con el que se combinó, por ejemplo: óxido de calcio.
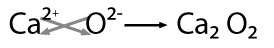
En este ejemplo hay posibilidad de obtener el mínimo común divisor entre los valores por lo que se obtiene: CaO -óxido de calcio-.
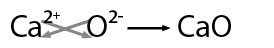
Cuando el metal presenta más de una valencia se nombran con la palabra genérica óxido seguida de la preposición de y después el nombre del metal, escribiendo entre paréntesis con número romano el valor de la valencia, por ejemplo:
Nomenclatura clásica ó tradicional
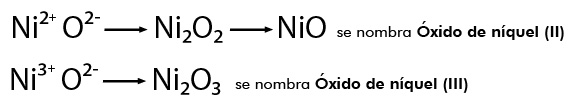
Estos mismos compuestos se pueden nombrar con la palabra genérica óxido seguida del nombre del metal con el sufijo oso para el valor menor de la valencia y con el sufijo ico cuando el valor de su valencia es mayor, por ejemplo:

Nomenclatura IUPAC
La IUPAC determina que estos compuestos se nombran a partir de la cantidad de elementos que los constituyen, por ejemplo:
NiO se nombra Monóxido de níquel y el Ni2O3 Trióxido de diníquel
Son combinaciones del oxígeno con un no metal y al reaccionar con agua producen ácidos del tipo oxiácido.

Nomenclatura Stock
Se nombra con la palabra óxido seguida de la preposición de, a continuación el nombre del no metal expresando con número romano el valor de la valencia con la que interactuó con el oxígeno, por ejemplo:
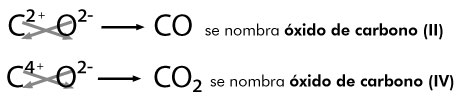
Nomenclatura clásica ó tradicional
Este mismo tipo de compuestos, también se pueden nombrar con la palabra genérica anhídrido seguida del nombre del no metal con el sufijo oso para el valor de la menor valencia e ico para el valor de la mayor valencia, por ejemplo:

Cuando el no metal presenta más de dos valencias como es el caso del cloro se conservan los sufijos de la regla anterior y se utilizan además: el prefijo hipo proveniente del griego "hypo" que significa inferior o debajo, y el prefijo hiper o per del griego "hyper" que significa mayor o superior, por ejemplo:

Nomenclatura IUPAC
Este tipo de compuestos se nombran a partir de la cantidad de elementos que constituyan a su representación simbólica, empleando las raíces griegas de los números correspondientes, por ejemplo:
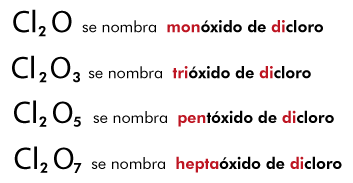
Dependiendo del número de valencias que presente el no metal, por ejemplo el carbono tiene dos valencias positivas 2+ y 4+, cuando actúa con el número de valencia 2+ al combinarse con el oxígeno 2-, se forma el monóxido de carbono, como se aprecia en la siguiente representación:

Cuando la combinación se lleva a cabo con la valencia 4+, resulta:

Una de las principales aplicaciones de las bases o hidróxidos es en la fabricación de los jabones que usamos a diario en casa.
¿Cómo se forman y nombran los hidróxidos?
Nomenclatura Stock
Cuando ya se tiene un óxido metálico, al combinarse con agua forma un hidróxido, también conocido como base, por ejemplo:
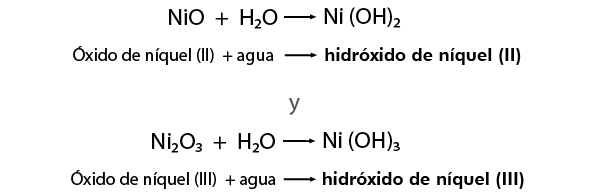
Nomenclatura clásica ó tradicional
Se conserva la misma nomenclatura para nombrar a los compuestos derivados de los óxidos metálicos formando los hidróxidos correspondientes y también se conservan los sufijos “oso” para el valor menor de la valencia e “ico” para el valor mayor, por ejemplo:

Nomenclatura IUPAC
Se conserva la misma nomenclatura, es decir, considerando la cantidad de elementos que constituyen el compuesto, por ejemplo:

Para aprender a escribir los modelos o las fórmulas de los hidróxidos con facilidad, puedes acudir a un recurso didáctico sencillo: combinar directamente el metal en forma de ion positivo con el radical hidroxilo con valencia 1- (OH)1-, como se muestra a continuación:
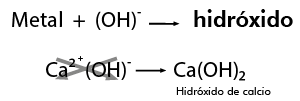
Cuando se tiene un óxido no metálico, al combinarse con agua forma un ácido de tipo oxiácido, se llaman oxiácidos porque en su composición está presente el oxígeno y la calidad ácida será determinada por la presencia del hidrógeno.
Estos tipos de compuestos son los que producen la lluvia ácida, ya que son productos de desecho de la industria y de vehículos de combustión interna (automotores), debido a que se combinan con la humedad y agua del ambiente.
Nomenclatura Stock
Se nombra al no metal con el sufijo ato, seguida del valor de la valencia del no metal y por último se agrega de hidrógeno.
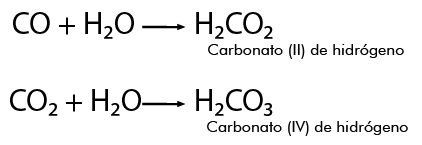
Nomenclatura clásica ó tradicional
Si observas, cuando los óxidos no metálicos se combinan con agua por síntesis o adición forman su ácido correspondiente, derivando su nombre del anhídrido del cual provenían, se pierde la palabra anhídrido, se cambia por ácido y conserva el nombre del anhídrido originario.
Por ejemplo, para formar los ácidos correspondientes del carbono, se parte de su óxido o anhídrido en presencia de agua, reaccionan y se produce:

Nomenclatura IUPAC
Se conserva la misma nomenclatura, es decir, considerando la cantidad de elementos que constituyen el compuesto, por ejemplo:

Este tipo de compuestos se forman con la combinación de un hidrógeno (H+) como ión positivo y un no metal (NM-) como ión negativo.
Nomenclatura Stock
Se nombran con el nombre del no metal con sufijo uro seguida de la preposición de y finalmente la palabra hidrógeno, en estado natural. Por ejemplo:

Nomenclatura tradicional e IUAPAC
En este caso convergen la nomenclatura clásica o tradicional y la de IUPAC, en éstas se nombran con la palabra genérica ácido seguida del nombre del no metal con el que se combinó y con el sufijo hídrico, en disolución acuosa, por ejemplo:
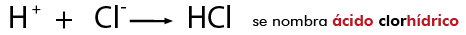
Para saber más
Una de las características de los óxidos metálicos es que son sólidos (óxido de zinc, ZnO), en tanto los óxidos no metálicos pueden ser sólidos (dióxido de carbono,CO2, a alta presión, llamado “hielo seco”), líquidos (agua H2O) o gases (dióxido de azufre, SO2).
Su estado físico depende de su estructura, es decir, si sus átomos entre sí forman redes o no; esto se comprende a partir
de las uniones interatómicas e intermoleculares.