Bohr y el átomo

Niels Bohr (1885-1962) físico danés, propuso dar una explicación de por qué los elementos presentaban los espectros de emisión y absorción y por qué eran diferentes unos de otros, para ello retomó los trabajos de Max Planck acerca de los cuantos o fotones y de Gustav Kirckhoff quien estudió el color que emitía la flama del mechero cuando quemaba algunas sustancias.
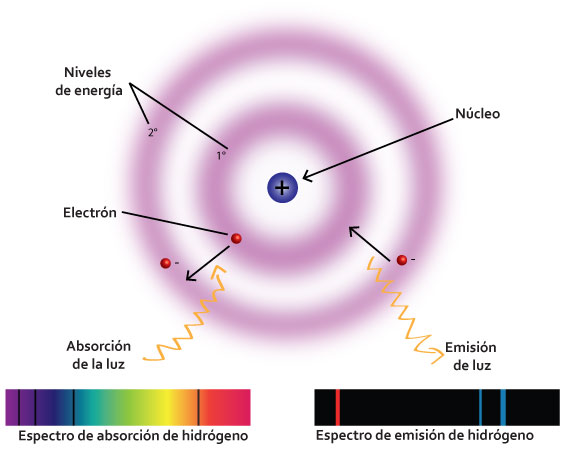
Bohr supuso que los electrones se encuentran y giran en órbitas definidas y que cada una contiene una cantidad de energía, por esta razón los llamó niveles de energía.
Planteó que en estado basal los electrones se encuentran girando en torno a su nivel de energía, pero que éstos pueden pasar de uno a otro, para ello necesitan absorber energía, si el electrón “salta” a un nivel de energía superior adquieren un estado excitado y se produce un espectro de absorción.
Al regresar a su estado basal emiten energía en forma de luz o fotones y producen un espectro de emisión. El éxito del modelo de Bohr consistió en que pudo predecir con precisión basándose en su modelo el espectro del Hidrógeno. A continuación da clic en las pestañas para que conozcas más acerca de dicho modelo:
Estas observaciones y cálculos matemáticos fundamentaron la propuesta de su modelo y la forma de distribuir los electrones en los niveles de energía. Da clic en el botón para que lo conozcas.

Distribución de electrones en los niveles de energía
Cada elemento tiene cierta cantidad de protones, a este número se le conoce como número atómico que se representa con la letra Z y como el átomo es eléctricamente neutro, tiene el mismo número de electrones.
Z = número de protones = número de electrones
Ejemplo de un elemento
Na Z=11
11 protones= 11 electrones
Si recuerdas el átomo también tiene neutrones que al sumarlos con los protones da como resultado el número de masa del elemento y se representa con la letra A.
A = número de masa = número de protones + número de neutrones
Número de neutrones = A – Z
Ejemplo
Na A=23
Número de neutrones = 23-11 = 12
Para determinar el número de masa de un elemento se considera la masa atómica (reportada en la tabla periódica) redondeando este valor a un número entero, ejemplo:
El número de neutrones del sodio es:
A = 22.9897, Z = 11 Número de neutrones = 23 – 11 = 12
Estos datos son importantes porque nos ayudarán a distribuir los electrones en los diferentes niveles de energía de acuerdo al Modelo atómico de Bohr.
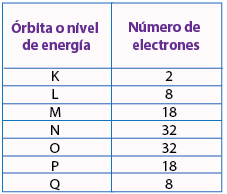
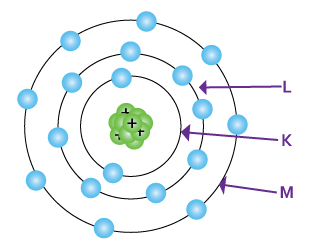
Cada órbita se corresponde con un nivel energético que recibe el nombre de número cuántico principal, se representa con la letra " n " y toma valores desde 1 hasta 7 o también son identificados con las letras del alfabeto K a Q.
La distribución de los electrones en los niveles de energía es el siguiente:


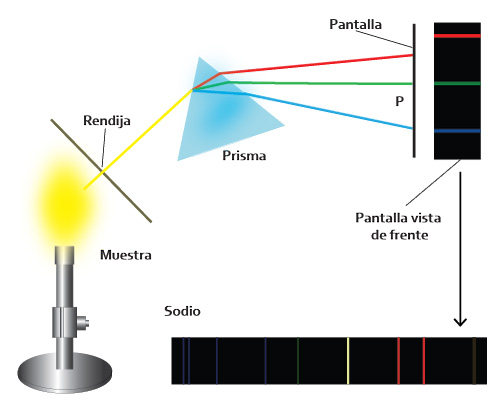
 Para que puedas apreciar mejor el espectro de emisión de sodio observa el siguiente video.
Para que puedas apreciar mejor el espectro de emisión de sodio observa el siguiente video.