Propiedades del carbono
El estudio del carbono es muy amplio, aquí se comenzará por revisar las principales propiedades del carbono que nos permitan explicar el cómo y el porqué logra formar la amplia gama de compuestos orgánicos que son la base de la composición de los seres vivos: animales y vegetales.
Antes de revisar las características de este elemento observa el video “El carbono” que aparece a continuación:
En la tabla periódica, el carbono es el primer elemento de la familia IV A de los elementos representativos y es un no metal. Se une químicamente con otros elementos para formar compuestos inorgánicos, como carburos (CaC2), óxidos (CO2) y sales (Na2CO3); pero también forma una inmensa gama de compuestos orgánicos también llamados compuestos del carbono, los cuales forman parte de las estructuras de los organismos vegetales y animales, los que a su vez son la fuente principal de la alimentación humana.
A continuación se muestra su ubicación en la tabla periódica y algunas de sus características principales:

Carbón
Número atómico: 6
Valencia: 4
No. Oxidación: 1, +4, -4
Electronegatividad: 2.5
Masa atómica: 12 (g/mol)
Radio atómico (A°): 0.914
Radio covalente (A°): 0.77
Configuración electrónica: 1s22s22p2

Observa la siguiente imagen:

Grafito y diamante
¿Podrías decir si ambos materiales son una misma sustancia ?
La respuesta es ¡Sí!
Aunque su apariencia y sus propiedades son completamente diferentes se trata de la misma sustancia, y es que se ha comprobado experimentalmente que tanto en el diamante como en el grafito se encuentran formados solamente por átomos de CARBONO; pero, ¿Qué establece estas diferencias? la respuesta la encontramos en la forma en que sus átomos se entrelazan y se distribuyen adquiriendo estructuras diferentes que establecen formas y características distintas.
El grafito tiene exactamente el mismo tipo de átomos que el diamante, pero por estar unidos y dispuestos en diferente forma, su textura, fuerza y color son diferentes; sin embargo, la descomposición del diamante es extremadamente lenta que sólo es apreciable a escala geológica. A las diferentes estructuras de sustancias con el mismo tipo de átomos se les conoce como formas alotrópicas, en este caso el diamante y el grafito son dos de los alótropos naturales más abundantes del carbono.
 Conoce más acerca de las propiedades y estructura del grafito y el diamante descargando el documento "Diamante y grafito".
Conoce más acerca de las propiedades y estructura del grafito y el diamante descargando el documento "Diamante y grafito".
Para que practiques lo aprendido te sugerimos que realices el Ejercicio 1.
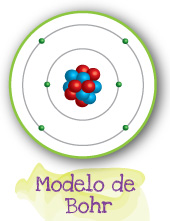
Hay dos modelos que se complementan para explicar la estructura atómica del carbono. El Modelo de Bohr y el Modelo de puntos de Lewis que se muestran a continuación:
El carbono es un elemento de número atómico 6, por lo tanto tiene 6 protones en su núcleo y 6 electrones girando en su alrededor; existen varios isótopos, aunque el más abundante tiene 6 neutrones.
Los electrones de este átomo se distribuyen en dos niveles: dos electrones en el primer nivel energético y cuatro en el segundo. Esta configuración electrónica hace que los átomos de carbono tengan múltiples posibilidades para unirse a otros átomos de manera que después de combinarse tenga su nivel externo completo. De acuerdo a la distribución electrónica de Bohr, para que este último nivel esté completo deberá contener 8 electrones y por lo tanto los átomos de C podrán combinarse con átomos que puedan contribuir con los electrones faltantes.
En general, a los electrones que tienen los átomos en su último nivel energético se les llama electrones de valencia, de esta forma el átomo de C tiene cuatro electrones de valencia. Por otro lado, un modelo que complementa al anterior y nos permite explicar el número de enlaces que pueden tener los átomos de C al formar moléculas, es el llamado Modelo de puntos de Lewis, en la cual se representan únicamente estos electrones de valencia ya que sólo ellos participan en los enlaces químicos. Este modelo indica que sólo los electrones que quedan sin pareja pueden formar enlaces químicos, precisamente completando su pareja de electrones.
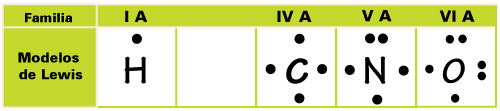
Así, considerando que el carbono tiene cuatro electrones en su último nivel (electrones de valencia) se le llama tetravalente, siendo la representación de su estructura de Lewis de la siguiente forma:

En una estructura de Lewis el número de electrones sin pareja determina el número de enlaces que se pueden formar en un átomo. Así los átomos de carbono tendrán la posibilidad de formar cuatro enlaces; ya que, en general, los átomos tienden a tener completa su capa de valencia para lograr su estabilidad energética; en el caso del Carbono esto se logra al unirse con otros elementos mediante la compartición de electrones, es decir, enlace covalente. El modelo de Lewis ayuda a explicar de forma sencilla la unión covalente que se da entre los diferentes átomos que se unen en los compuestos orgánicos. En éstos es común encontrar a los átomos de C unido a otros elementos como hidrógeno, oxígeno, nitrógeno, azufre y fósforo (CHONSP), los cuales tienen un número de electrones igual al número de la familia a la que corresponden.
La distribución de electrones ayuda a explicar las múltiples posibilidades que tienen los átomos de carbono para unirse consigo mismo formando largas cadenas, las cuales pueden continuar de manera horizontal, vertical, hacia adelante o hacia atrás. El modelo también explica cómo se enlazan los átomos de C con átomos de otros elementos.
En el Modelo de puntos de Lewis se escribe el símbolo del elemento y se colocan siguiendo la dirección de las manecillas del reloj primero: un electrón en la parte superior, otro a su derecha, otro abajo, otro del lado izquierdo del símbolo. Si el elemento por representar tuviera más electrones se coloca otro en la parte superior, para representar un par de electrones hasta completar los 8 electrones, de acuerdo con la regla del octeto. A continuación algunos ejemplos:

Son los electrones que se quedan sin pareja pueden formar enlaces químicos, precisamente completando su pareja de electrones.
El metano es el compuesto más pequeño de los millones de compuestos que llegan a formarse cuando se combinan átomos carbono e hidrógeno.
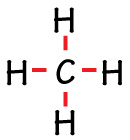
Otras representaciones del metano son las siguientes:
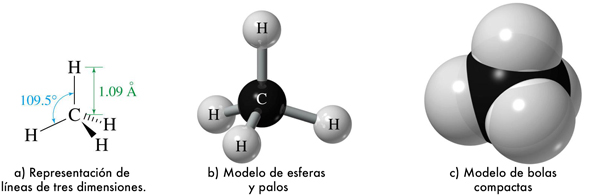
Esta figura muestra los enlaces covalentes que se pueden formar entre los átomos de C mediante la compartición de electrones, aunque también se muestran electrones sin pareja que pueden establecer otros enlaces.
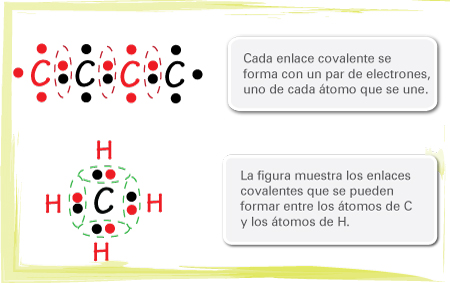
En las estructuras desarrolladas de los diferentes compuestos orgánicos es común visualizar el par de electrones que se comparte como una línea que une los símbolos, como se muestra a continuación:
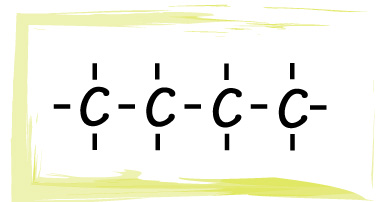
Para saber más
 Para que conozcas más acerca del tema, te sugerimos que observes el video “Enlace carbono-carbono”.
Para que conozcas más acerca del tema, te sugerimos que observes el video “Enlace carbono-carbono”.
 Además te pedimos que revises el documento "Enlace covalente" en el que se amplía la información acerca del enlace covalente. Da clic en la imagen o el hipervinculo para que lo descargues.
Además te pedimos que revises el documento "Enlace covalente" en el que se amplía la información acerca del enlace covalente. Da clic en la imagen o el hipervinculo para que lo descargues.
