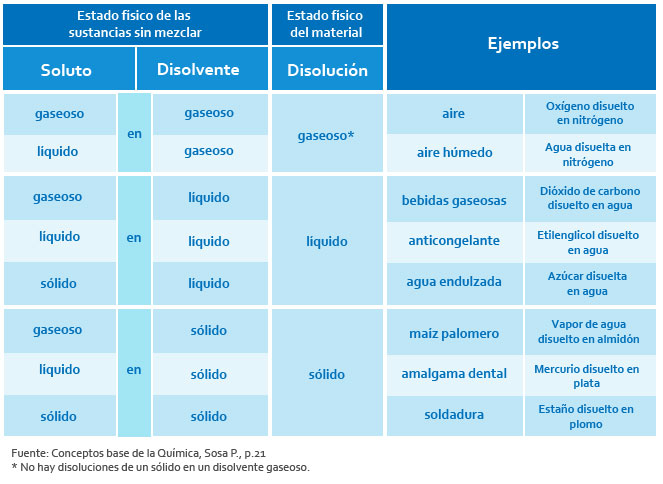
De este tipo, la disolución más común para nosotros es el aire, que es una disolución gaseosa de nitrógeno (78%), oxígeno (21%) y otros gases como: bióxido de carbono, argón, kriptón y vapor de agua en menor proporción. Es importante aclarar que no hay disoluciones de un soluto sólido en un disolvente gaseoso (Sosa, 2007).

Éstas también son muy comunes a nosotros, principalmente aquellas en donde participa el agua como disolvente (recuerda que es llamado el disolvente universal), y se les denomina disoluciones acuosas. Por ejemplo, las bebidas carbonatadas contienen dióxido de carbono gaseoso disuelto en agua. También el agua del océano es una disolución acuosa en la que se encuentran disueltas el cloruro de sodio (como la sal de mesa), más o menos en 77% de las sales marinas; en este caso se dan interacciones químicas (Sosa, 2007), pues el cloruro de sodio (NaCl) se separa en dos partes Na+ (que le llamaremos ion sodio) y Cl- (que le llamaremos ion cloro), mismos que son “secuestrados” y cada uno es rodeado por millones de moléculas de agua.
Recuerda que la molécula de agua está compuesta por dos átomos de hidrógeno y un átomo de oxígeno, las moléculas de agua cercanas a los iones Na+ se encuentran orientadas hacia el oxígeno (polo negativo de la molécula de agua), mientras que las moléculas de agua cercanas a los iones Cl- se encuentran orientadas hacia los hidrógenos (polo positivo de la molécula de agua), dando como resultado la disolución del cloruro de sodio.

En este tipo de disoluciones, el disolvente y el soluto son sustancias sólidas. Cuando se dan entre elementos metálicos se llaman aleaciones (no todas las mezclas de dos o más metales son disoluciones sólidas, algunas son mezclas heterogéneas como lo es la aleación plomo-estaño para soldadura. Petrucci, 1977). Las aleaciones se producen combinando los elementos que las componen en estado fundido seguido de enfriamiento, alear cambia las propiedades físicas y la resistencia a la corrosión, calor, entre otras propiedades del material.
Muchos sólidos presentan en su estructura redes cristalinas y en los metales, cuando se produce una aleación de sustitución, los átomos del soluto ocupan posiciones en la red del metal disolvente. Para mantener la estructura original de la red del metal base, los átomos de ambos componentes deben ser de tamaño similar. Por ejemplo, la plata de ley (utilizado en cubiertos y joyería) contiene 92.5% de plata (Ag) y 7.5% de cobre (Cu) y los átomos de ambos componentes son de tamaño similar.
Cuando la estructura del metal disolvente presenta una red con empaquetamiento compacto se produce una aleación intersticial, pues contiene huecos llamados intersticiales de forma tetraédrica y octaédrica en donde se pueden acomodar átomos considerablemente pequeños. Por ejemplo: el acero al carbono bajo contiene entre 0.03 y 0.25% de carbono en una red de hierro (Fe), y se utiliza para chapas de acero, fabricación de recipientes de acero y en la industria de los vehículos de motor. El acero al carbono medio contiene entre 0.25 y 0.70% de carbono en una red de hierro y se utiliza en la fabricación de tornillos, tuercas, partes de maquinaria, barras de conexión y rejas. El acero al carbono alto, el más fuerte de los aceros al carbono, contiene entre 0.8 y 1.5% de carbono y se utiliza en la fabricación de herramientas para cortar y taladrar (Housecroft, 2006).
Cuando el material fundido de algunas mezclas de metal solidifica, la aleación formada puede poseer un tipo definido de red diferente a los metales puros, dando como resultado a un compuesto intermetálico.
 Cuando el material fundido de algunas mezclas de metal solidifica, la aleación formada puede poseer un tipo definido de red diferente a los metales puros, dando como resultado a un compuesto intermetálico.
Cuando el material fundido de algunas mezclas de metal solidifica, la aleación formada puede poseer un tipo definido de red diferente a los metales puros, dando como resultado a un compuesto intermetálico.
