A continuación estudiaremos los conceptos químicos más importantes con los que tenemos relación en nuestra vida cotidiana. Comenzaremos por la materia, que se define como todo lo que ocupa un lugar en el espacio, posee masa y/o la podemos captar por medio de nuestros sentidos. La materia está formada por moléculas y átomos; nos concentraremos en modelos operativos de moléculas de agua, oxígeno e hidrógeno. Lo haremos para tener un conocimiento más preciso de lo que es un elemento, formado por un mismo tipo de átomos, y de lo que es un compuesto, formado por más de un tipo diferente de átomos, en donde tanto átomos como moléculas se unen entre sí mediante enlaces químicos. A ambos términos, elemento y compuesto, se les conoce tambien como sustancias puras, cuando existen dos o más de ellas unidas entre sí, sin que se afecten las características particulares de cada una de ellas y, además, pueden separarse fácilmente por métodos físicos, las consideramos como mezclas.
Haz clic en cada uno de los conceptos para conocer una amplia definición de éstos.
Átomo
Hace más de 2450 años, el filósofo griego Leucipo, tomó un puñado de arena y lo friccionó poco a poco entre sus dedos ante su discípulo Demócrito. Mientras desmenuza la arena se pregunta sobre cómo podría estar formado todo lo que nos rodea, es decir, cómo podría estar conformada la estructura de la materia. Reflexionó si se podría continuar desmenuzando el fino polvo hasta llegar a una mínima partícula. Esta partícula sería indivisible e indestructible; Demócrito la denominó átomo que significa, precisamente, ‘indivisible’. El átomo representa el límite mínimo de la división de la materia.
“El átomo es la unidad más pequeña posible de un elemento químico que mantiene sus propiedades de tamaño y masa” (Dillard, R. y Goldberg, D. E., 1977: 4).
¿Alguna vez se te ha ocurrido pensar en la relación que existe entre los átomos y las reacciones químicas?
Esta pregunta la resolveremos a continuación. Lo haremos estudiando la relación que guardan los principales conceptos químicos.

Leucipo de Mileto (s. V a. C.)
De acuerdo con el origen del concepto del átomo, se podría decir que los átomos son las partículas más pequeñas que forman un elemento y que, además, determinan sus propiedades. Por ejemplo, el elemento oro está formado por átomos cuyas características permiten que sea un metal maleable y dúctil.
Cuando se agrupan los átomos forman moléculas que, si son del mismo tipo, constituyen a los elementos. Si estos átomos son de diferente tipo constituyen a los compuestos. Los átomos se unen entre sí por fuerzas de atracción denominadas enlaces interatómicos.
Los únicos elementos que se encuentran en la naturaleza como átomos aislados (monoatómicos) son los gases nobles: Helio-He, Neón-Ne, Argón-Ar, Kriptón-Kr, Xenón–Xe y Radón-Rn. Los gases nobles, por ser muy estables, no tienen la necesidad de unirse entre ellos.

Sin embargo, la mayoría de los elementos se presentan como iones (átomos con carga eléctrica), moléculas (formadas por dos o más átomos) y redes cristalinas (que pueden estar formadas por muchísimos más átomos).
Los átomos son extremadamente pequeños. Su diámetro es del orden de $10^{-8}$ cm, por lo que se requieren más de 100 millones de átomos acomodados en línea para cubrir una longitud de 1 cm.
Molécula y enlace químico
Una molécula es un grupo de dos o más átomos ligados entre sí que se encuentran unidos por una fuerza a la que llamamos enlace químico. Por ejemplo, el átomo de hidrógeno no lo encontramos solo en la naturaleza, sino como moléculas formadas por pares de átomos.
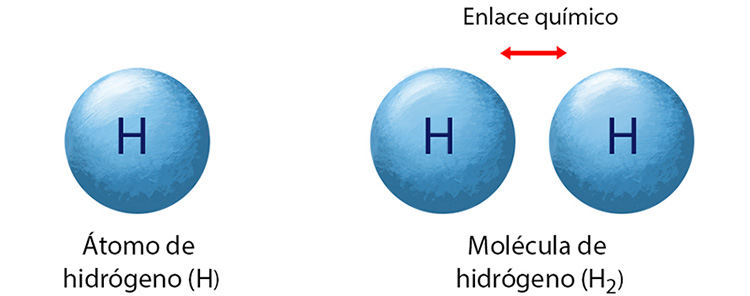
El enlace químico es una fuerza de atracción que mantiene unidos a los átomos (enlace interatómico) para formar las moléculas; éstas a su vez se atraen y forman los enlaces intermoleculares que determinan la formación de sólidos, líquidos o gases.
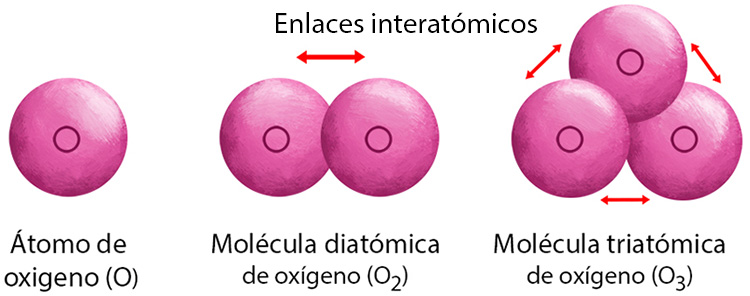
De igual manera que el hidrógeno, el oxígeno se presenta en la naturaleza casi siempre como una molécula diatómica y en mucho menor proporción, como molécula triatómica a la que conocemos como ozono. Ambas moléculas se representan con su símbolo, acompañado de un subíndice. El subíndice nos indica el número de átomos que forma la molécula.
Elemento
Es una sustancia que no puede descomponerse en otra clase de materia más simple por ningún proceso físico o químico. Sin importar su origen, siempre tendrá las mismas propiedades, las cuales lo identifican. Éstas son físicas como su densidad, color, punto de ebullición; o químicas si son combustibles, reactivas o no, entre otras. Debido a las propiedades específicas de las sustancias puras, se utiliza este término para designar a cualquier elemento o compuesto. A continuación observamos una tabla con algunas de las propiedades más comunes de los elementos.
| Propiedades físicas | Propiedades químicas |
|---|---|
Son las características que se pueden observar o medir sin cambiar la identidad de la sustancia como:
|
Se refieren a la capacidad de una sustancia de transformarse en otra en donde cambia su composición, y son: |
Elemento es, entonces, la sustancia cuyas moléculas están formadas por el mismo tipo de átomos y del que no se puede obtener por procedimientos químicos otra más sencilla.
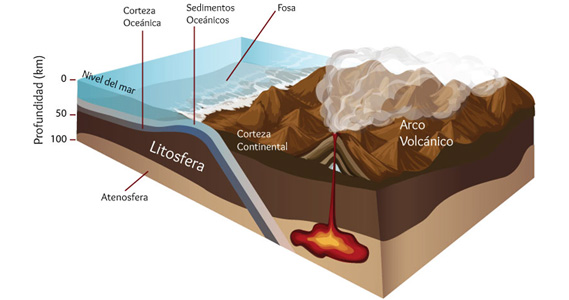
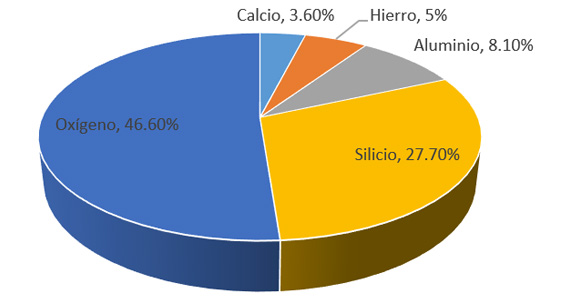
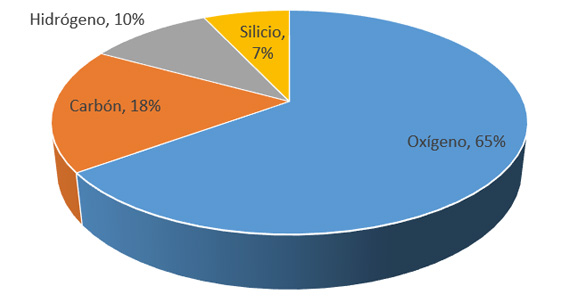
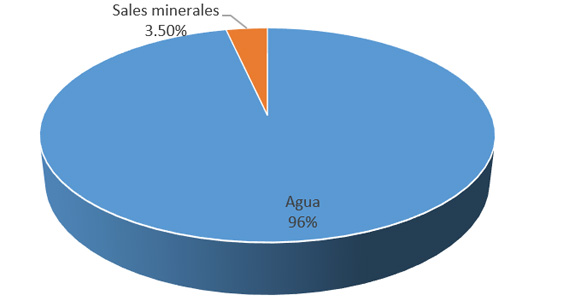
Los elementos químicos más importantes por su abundancia en la litósfera, en el cuerpo humano y en el hemisferio oceánico respectivamente son:
El 90% de la corteza terrestre se compone únicamente de 5 elementos: Oxígeno, Silicio, Aluminio, Hierro y Calcio. Más del 90% de nuestro cuerpo está formado a partir de 3 elementos: Oxígeno, Carbono e Hidrógeno. En los oceános, el agua representa el 96.5% y el resto son sales minerales. Todos estos elementos se encuentran formando compuestos o mezclas, salvo algunas excepciones como el oxígeno, nitrógeno, oro, platino y los gases nobles, entre otros.
De los casi 120 elementos conocidos por el hombre, aproximadamente 90 existen en la naturaleza y el resto han sido producidos artificialmente en laboratorios. Debido a la cantidad tan numerosa de elementos existentes, se buscó la manera de identificarlos de forma rápida y sencilla mediante símbolos que los representen, además de una tabla que los organizara de acuerdo con sus propiedades: la Tabla periódica de los elementos.
De todos los elementos conocidos, sólo siete se presentan como moléculas diatómicas en su forma más estable (Hein, 1992). Estos son:
Elemento

Símbolo
H
Fórmula
H2
Estado físico
Gas incoloro
Modelo de representación molecular

Elemento

Símbolo
N
Fórmula
N2
Estado físico
Gas incoloro
Modelo de representación molecular

Elemento

Símbolo
O
Fórmula
O2
Estado físico
Gas incoloro
Modelo de representación molecular

Elemento

Símbolo
F
Fórmula
F2
Estado físico
Gas amarillo pálido
Modelo de representación molecular

Elemento

Símbolo
Cl
Fórmula
Cl2
Estado físico
Gas amarillo verdoso
Modelo de representación molecular

Elemento

Símbolo
Br
Fórmula
Br2
Estado físico
Líquido café rojizo
Modelo de representación molecular
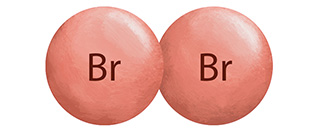
Elemento

Símbolo
I
Fórmula
I2
Estado físico
Sólido negro violeta
Modelo de representación molecular

Compuesto
Los compuestos son combinaciones químicas de dos o más elementos en relaciones simples de números enteros que poseen propiedades diferentes a las de los elementos que los constituyen.
Un compuesto puro tiene la misma composición y propiedades, sin importar si su origen es natural o artificial. Por ejemplo: en el caso del agua sus propiedades son las mismas si obtenemos agua pura a partir de su síntesis o la purificamos a partir del agua de mar o la lluvia.
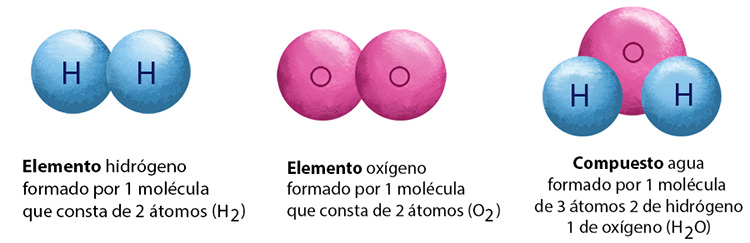
Comparación entre el hidrógeno, el oxígeno y el agua
| Elemento hidrógeno | Elemento oxígeno | Compuesto agua | ||
|---|---|---|---|---|
| Estado físico* | Gas | Gas | Líquido | |
| Punto de ebullición (°C) | -253 | -183 | 100 | |
| Densidad (g/cm3)* | 0.00009 | 0.00143 | 1.00 | |
| Combustible | Sí | No | No | |
*A temperatura y presión atmosférica ambiental
Fuente: Brown T., LeMay, H. E., Bursten, B. E., et al. (2009)
Como puedes observar en la tabla anterior, las propiedades del agua son muy diferentes a las propiedades de los elementos que la componen. Algunos compuestos se utilizan en el hogar, de acuerdo con sus propiedades químicas, por ejemplo: el hidróxido de sodio (NaOH) conocido como sosa caústica y el peróxido de hidrógeno H2O2 conocido como agua oxigenada.

Uso: Desengrasante en la cocina. Propiedades: Reacciona con las grasas, fuerte oxidante.

Uso: Antiséptico, decolorante del cabello. Propiedades: Fuerte oxidante.
Mezcla
Es la unión de dos o más sustancias puras en proporciones variables, en donde cada una de ellas conserva las propiedades que la caracterizan. Esto se debe a que no ocurre entre ellas reacción química alguna.
Las mezclas se identifican por dos características: tener una composición variable de las sustancias que la constituyen y el hecho de poder ser separadas por métodos físicos, por ejemplo destilación, decantación, evaporación, etc.
La mayor parte de las sustancias que se encuentran en la naturaleza son mezclas. Las mezclas se subdividen en homogéneas, cuando no se distinguen a simple vista sus componentes, por ejemplo agua y alcohol; y heterogéneas cuando se distinguen con facilidad y a simple vista sus componentes, por ejemplo cuando mezclamos agua y arena.
| Solución de agua con sal | Aire |
|---|---|
 |
 |
| Agua con aceite | Agua con limadura de hierro |
|---|---|
 |
 |
Observa la tabla que se presenta a continuación para conocer la diferencia entre mezclas y compuestos (Hein, M., 1992):
Comparación de mezclas y compuestos
| Mezcla | Compuesto | ||
|---|---|---|---|
| Composición | Puede constar de varios elementos, compuestos, o ambos, en composición variable. 3.5% de sal 96.5% de agua |
Se compone de dos o más elementos en una proporción en masa, definida y fija o invariable. H2O 100% |
|
| Separación de los componentes | La separación se puede llevar a cabo por medios físicos o mecánicos: podemos separar el agua de la sal por evaporación. | Los elementos se pueden separar sólo mediante reacciones químicas: podemos separar los elementos que componen el agua por electrólisis. | |
| Identificación de los componentes | Los componentes no pierden su identidad o características propias: al separar el agua de la sal cada una mantiene sus propiedades, una sólida y la otra líquida. | Un compuesto se diferencia de los elementos a partir de los cuales está formado. El oxígeno y el hidrógeno se presentan en forma de gas, mientras que el agua se presenta a temperatura ambiente como líquida. | |



 Átomo
Átomo Molécula
Molécula Elemento
Elemento Compuesto
Compuesto Mezcla
Mezcla