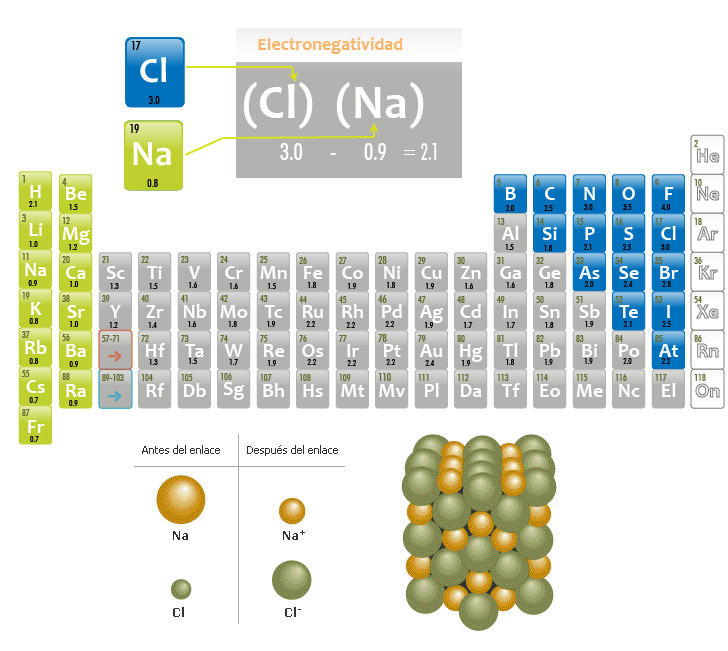
Enlace iónico (diferencia entre 1.7 y 3.3 )
Un enlace iónico se forma cuando los electrones se transfieren completamente de un átomo a otro. Durante este proceso, un átomo pierde electrones y otro los gana, formándose iones. Este fenómeno se presenta entre átomos con diferencias de electronegatividad muy alta (superior o igual a 1.7), el átomo más electronegativo atrae con mayor intensidad los electrones logrando “arrancar” el electrón del elemento menos electronegativo.
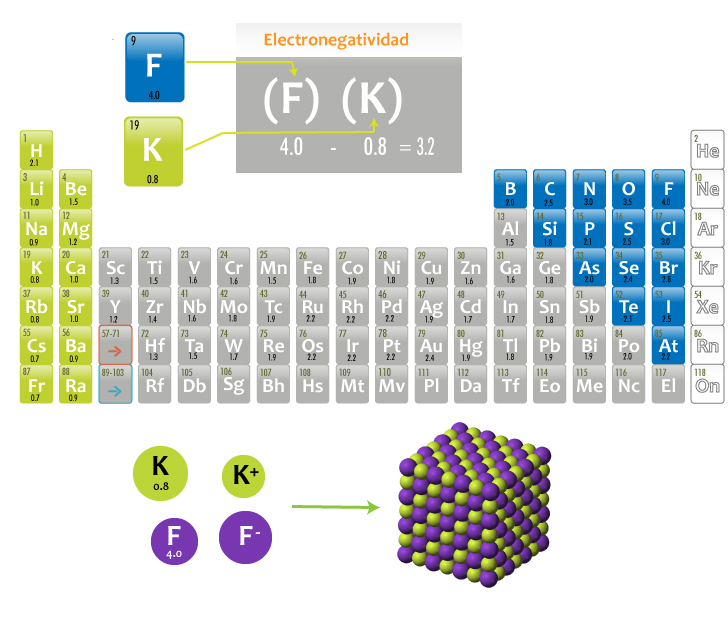
Analicemos el caso del fluoruro de potasio (KF); la electronegatividad del átomo de potasio (0.8) es menor que la del flúor (4.0), por lo que el flúor atrae el electrón de valencia del potasio. Al determinar la diferencia de electronegatividades: 4.0 - 0.8= 3.2, se obtiene un valor que se encuentra en el intervalo para enlaces iónicos. Debido a lo anterior se generan las especies iónicas K+ y F- para formar una red iónica.
Observa la formación de la red iónica en los siguientes esquemas:
Formación del fluoruro de potasio (KF)
Formación del cloruro de sodio (NaCl)