Enlace covalente polar (diferencia entre 0.5 y 1.6)
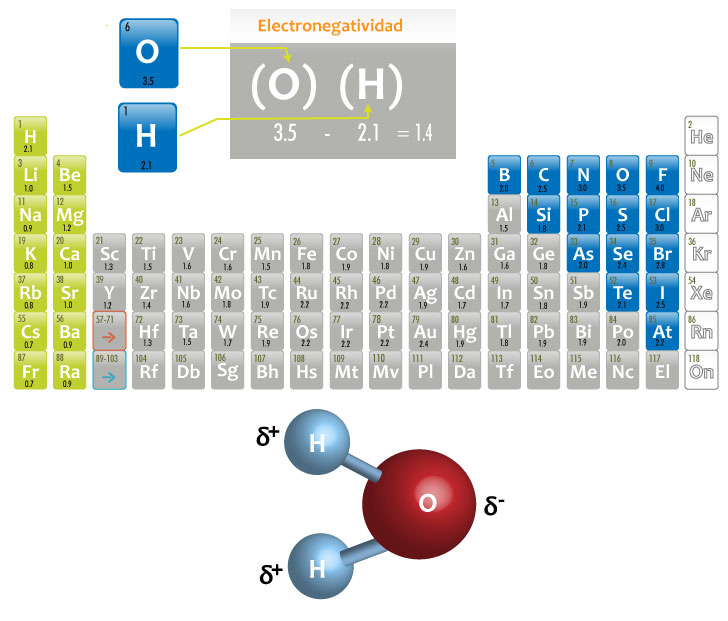
Cuando los átomos del enlace covalente tienen electronegatividades distintas, los electrones compartidos estarán más próximos al elemento de mayor electronegatividad, provocando un reparto desigual de electrones, formando lo que se denomina un dipolo eléctrico: una carga parcial negativa δ- sobre el átomo más electronegativo y una carga parcial positiva δ+ sobre el átomo menos electronegativo. A este tipo de enlace se le llama covalente polar.
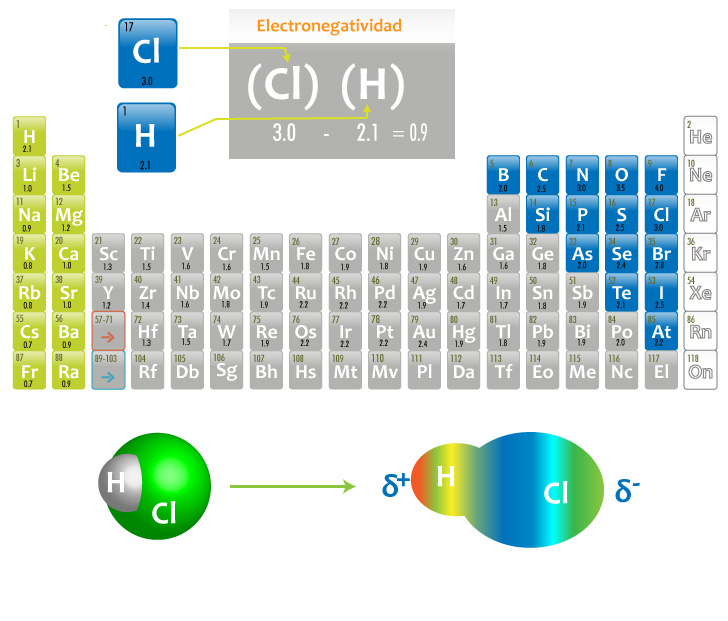
Por ejemplo entre Cl-H, el átomo de cloro (Cl) al ser más electronegativo (3 Pauling) atrae más densidad electrónica que el átomo de hidrógeno (H) (2.1 Pauling), lo cual genera una diferencia de electronegatividad de 0.9. Cuando esto ocurre la nube electrónica se modifica y se forman polos parciales (el cloro δ- y el hidrógeno δ+).
En términos generales en un enlace covalente polar el rango de la diferencia de electronegatividad es de 0.5 a 1.6.
En los siguientes esquemas podrás observar dos ejemplos de enlaces covalentes polares:
Formación del ácido clorhídrico (HCl)
Formación del agua (H2O)