Las reacciones de síntesis o combinación ocurren cuando dos o más reactivos forman un solo producto; generalmente se libera calor (Δ) (reacción exotérmica). También se les conoce como reacciones de adición.
La forma general de la ecuación para este tipo de reacciones es el siguiente:
A + B AB
Las reacciones que entran en esta categoría son:
- Metal + oxígeno produce óxido metálico
Ejemplo 4 Al(s) + 3 O2(g) 2 Al2O3(s) [óxido de alumnio]
2 Al2O3(s) [óxido de alumnio] - No metal + oxígeno produce óxido no metálico
Ejemplo 2 C(s) + O2(g) 2 CO(g) [bióxido de carbono]
2 CO(g) [bióxido de carbono] - Metal + no metal produce sal binaria
Ejemplo 2 Al(s) + 3 S(s) Al2S3(s) [sulfuro de aluminio]
Al2S3(s) [sulfuro de aluminio] - Óxido metálico + agua produce una base o hidróxido metálico
Ejemplo Mg(s) + H2O(l) Mg(OH)2(s) [óxido de magnesio]
Mg(OH)2(s) [óxido de magnesio] - Óxido no metálico + agua produce un oxiácido
Ejemplo SO2(g) + H2O(l) H2SO3(ac) [ácido sulfúrico]
H2SO3(ac) [ácido sulfúrico]
Importancia de las reacciones de síntesis o combinación
En las reacciones de síntesis se producen compuestos químicos a partir de sustancias más simples o elementales.
Los objetivos principales de la síntesis química son:
- Producir nuevas sustancias químicas útiles al hombre que no existen en forma natural, como por ejemplo:
- Obtención de medicinas
- Preparación de detergentes
- Obtención del acero
- Síntesis de cosméticos
- Obtención de plásticos y adhesivos
- Desarrollar métodos más económicos, simples y eficientes para sintetizar sustancias naturales ya existentes como el látex (presente en el árbol del caucho o hevea brasiliensis), el ácido ascórbico o vitamina c (presente en los cítricos) o el ácido acetilsalicílico (presente en las hojas del árbol llamado sauce llorón), por citar algunos.
Reacciones de descomposición
Ahora observa el siguiente video:
En este tipo de reacciones químicas se descompone un reactivo en dos o más productos (que pueden ser elementos o compuestos) por medio de un agente externo o un catalizador.
Si la descomposición ocurre por calentamiento a altas temperaturas se le llama pirólisis.
Si la descomposición ocurre mediante la luz se le conoce como fotólisis.
Si la descomposición es provocada por un catalizador se le llama catálisis.
Si la descomposición se realiza con la ayuda de la electricidad se le llama electrólisis.
 CaO(s) + CO2
CaO(s) + CO2 [carbonato de calcio produce óxido de calcio + bióxido de carbono]
 2 Na(s) + Cl2(g)
2 Na(s) + Cl2(g) [cloruro de sodio produce sodio + cloro]
 2 C2H5OH(ac) + 2 CO2(g)
2 C2H5OH(ac) + 2 CO2(g) [glucosa produce etanol + bióxido de carbono]
 2 H2O(l) + O2(g)
2 H2O(l) + O2(g) [peróxido de hidrógeno produce agua + oxígeno]
Importancia de las reacciones químicas de descomposición (o análisis)
A continuación se dará una breve explicación sobre la importancia de las reacciones de descomposición o análisis químico como procedimiento para establecer la naturaleza de la materia.
Para saber si una sustancia pura es un compuesto o un elemento, la sustancia es sometida a métodos de descomposición o análisis, como por ejemplo, la electrólisis del agua.
2H2O  2H2 + O2
2H2 + O2
El compuesto agua (H2O) se descompone por electrólisis en los elementos hidrógeno y oxígeno.
Otro ejemplo de reacción de descomposición o análisis es cuando utilizamos peróxido de hidrógeno (agua oxigenada) como desinfectante. Cuando ésta reacciona con la sangre o suciedad en las heridas, se descompone y se desprende oxígeno (oxígeno nativo) según la ecuación:
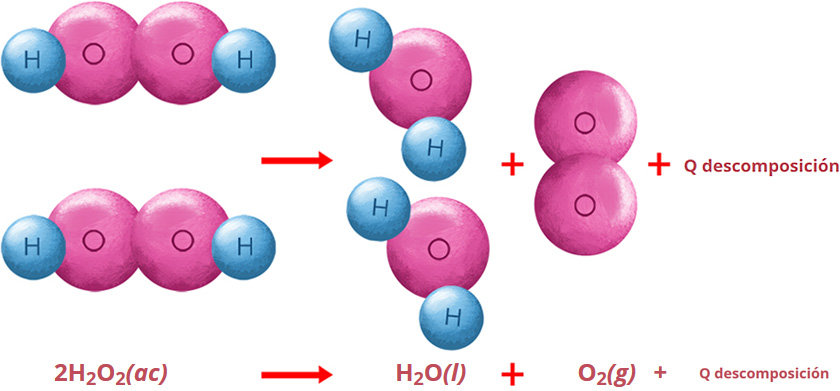
El oxígeno desprendido es el que desinfecta la herida. La letra Q identifica al calor desprendido por la descomposición y por este motivo tambien se le puede calificar como una reacción exotérmica.
La descomposición de moléculas de agua por medio de electricidad para producir moléculas de los elementos hidrógeno y oxígeno es también un ejemplo de reacción de descomposición.
Para saber más
El método de inspección o de tanteo se utiliza para balancear ecuaciones químicas probando diferentes coeficientes estequiométricos para igualar el número de átomos de cada elemento en ambos lados de la ecuación. Es un método de prueba y error en el cual, generalmente, se siguen estas reglas:
- Se contabilizan los átomos de cada elemento en los reactivos y en los productos.
- Se iguala el número de átomos asignando el coeficiente adecuado, comenzando por los metales, se continúa con los no metales, luego el hidrógeno y por último el oxígeno.
- Una vez asignados todos los coeficientes, se verifica la igualdad.


