Los químicos utilizan un lenguaje estándar para representar los cambios que ocurren en una reacción de modo que haya un mejor entendimiento de lo que sucede en las transformaciones de algunas sustancias.
Por ejemplo, la ecuación de disolución del hidróxido de sodio (NaOH) es:

Donde las letras dentro de los paréntesis de cada una de las sustancias, en termoquímica, indican lo siguiente:
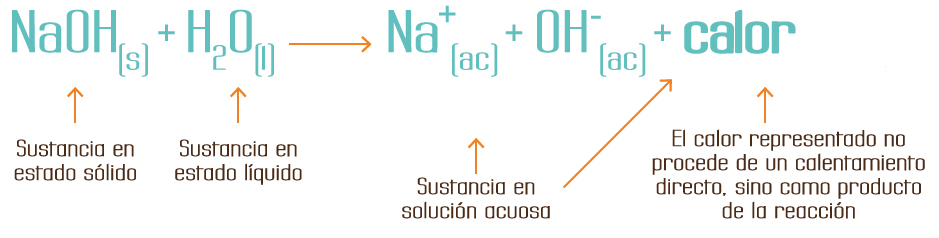
En la ecuación se observa que el hidróxido de sodio (NaOH) está en estado sólido y cuando reacciona con el agua en estado líquido produce o se forman iones sodio (Na+ (ac)) en estado acuoso y iones hidroxilo (OH- (ac)) también en estado acuoso, y al mismo tiempo hay un desprendimiento de calor.
- ¿Cómo aparecerá el calor si en lugar de escribirlo como producto lo anotas como reactivo? y ¿Qué representará?
La reacción necesitará calor para efectuarse y por lo tanto la reacción deberá escribirse en forma contraria, como se ilustra a continuación:

El signo del calor como identificador de las reacciones termoquímicas
El uso del lenguaje químico es importante para determinar si una reacción es exotérmica o endotérmica.
El calor es energía en transferencia a través de las paredes de un sistema. Este cambio de energía se representa como:

Donde E = Energía
Ejemplo:
La ecuación para la formación del hielo se puede escribir:
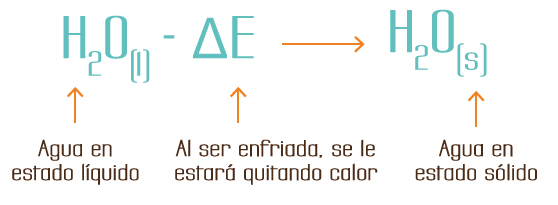
En termoquímica, es costumbre escribir el calor de reacción a la derecha de la ecuación química:

En la evaporación del agua se escribirá:

Para saber si una ecuación termoquímica es endotérmica o exotérmica basta fijarte en el signo del calor (ΔE) de tal forma que:



