Actividad Final
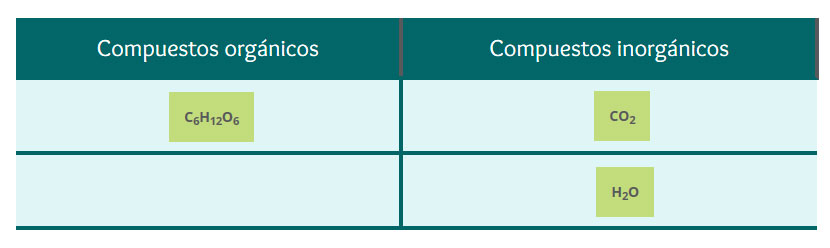
Con base a los ejercicios que a continuación se te presentan, clasificarás diferentes compuestos en orgánicos e inorgánicos, a partir de sus propiedades. También distinguirás a las reacciones químicas endotérmicas de las exotérmicas, en función del calor que generan o requieren cuando se llevan a cabo. Esto para explicar la generación de energía partir de las reacciones de combustión y la importancia que tiene este proceso en la vida cotidiana.
Para saber más
Sobre los combustibles y cómo podemos utilizarlos de forma más eficiente para evitar el deterioro del planeta, revisa el siguiente video:
Alumno: